ヒト赤血球膜タンパク質バンド3の構造と機能
バンド3蛋白質は哺乳類の赤血球に存在する陰イオン(HCO3- ⇔ Cl-)トランスポーターであり、全世界で多くの研究者が結晶化に挑戦してきましたが、高解像度を得るまでに至っていません。本研究室では、数十年前からバンド3の構造と機能について研究を行っており、蓄積されたデータを多数保持している優位性を生かして、結晶化と構造解析に取り組んでいます。
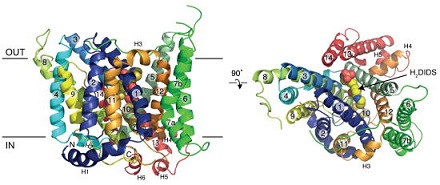
現在、京都大学医学研究科(岩田想教授)との共同研究により、抗体存在下におけるバンド3の結晶化に成功しており、科学雑誌 Science に発表されました。また、宇宙ステーション「きぼう」を利用した研究プロジェクトに採択され、2010年~現在まで数度の打ち上げを行い、微小重力下におけるバンド3の結晶生成にもチャレンジしています。
共同研究先:京都大学医学研究科、九州大学医学研究院、理化学研究所ほか
 |
 |
代表論文
- Arakawa T, Kobayashi-Yugiri T,Alguel Y, Iwanari H, Hatae H, Iwata M, Abe Y, Hino T, Ikeda-Suno C, Kuma H, Kang D, Murata T, Hamakubo T, Cameron D. A, Kobayashi T, Hamasaki N, Iwata S. "Crystal structureof the anion exchanger domain of human erythrocyte band 3" Science 350: 680-684, 2015
- Takazaki S, Abe Y, Yamaguchi T, Yagi M, Ueda T, Kang D, Hamasaki N. "Arg901 in the AE1 C-terminal tail is involved in conformational change but not in substrate binding" Biochim Biophys Acta 1818 (3): 658-665, 2012
- Yamaguchi T, Ikeda Y, Abe Y, Kuma H, Kang D, Hamasaki N, Hirai T. "Structure of the Membrane Domain of Human Erythrocyte Anion Exchanger 1 Revealed by Electron Crystallography" J Mol. Biol., 397 (1): 179-189, 2010




